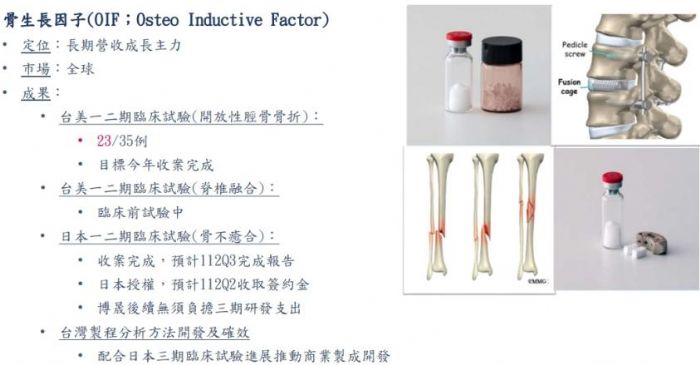
博晟宣布其BiG-001臨床試驗完成,預計今年下半年公布期中結果。此試驗比較不同劑量的骨誘導因子(OIF)與自體骨移植的效果,旨在解決骨癒合未滿足的需求。不同於現有治療,博晟的骨生長因子由大腸桿菌系統生產,避免使用動物源材料,減少了潛在的疾病風險。隨著全球生物性骨材市場的增長,博晟的產品已在日本和中國獲得授權,展示了其在骨修復和再生領域的潛力。
650字新聞稿
在醫療科技領域裡,博晟近日宣布其創新的BiG-001 (OIF/ß-TCP)骨生長因子臨床試驗已經完成,這項在台灣和美國進行的開放性脛骨骨折可行性臨床試驗,為骨癒合技術的進步開啟了新篇章,特別是對於那些遭受延遲癒合或骨不癒合困擾的患者而言。
博晟董事長陳德禮強調,骨延遲癒合或不癒合對患者的生活及工作影響重大,且會引發後續的高昂家庭及社會照顧成本。傳統的治療方式如自體骨移植,雖被視為黃金標準,但存在著捐贈部位的創傷及骨量不足的限制。因此,博晟致力於開發骨生長因子,以滿足臨床上對骨再生的未滿足需求。
目前市場上針對脛骨骨折和脊柱融合的治療選項有限,主要是Medtronic的Infuse Bone Graft。然而,由於其載體使用動物組織細胞,存在著狂牛症感染的風險,這迫切需要更安全的替代品。博晟的解決方案透過重組大腸桿菌系統生產,避免了使用動物源材料,提供了對比現有產品的重大優勢。
根據QYResearch的報告,全球生物性骨材市場預計將從2020年的511.74百萬美元增長至2026年的688.7百萬美元,年複合成長率為4.8%。這一增長趨勢凸顯了對創新骨癒合解決方案的日益增加的需求。
博晟的骨生長因子已在日本和中國獲得授權,並且基於日本臨床試驗觀察到的87.5%的骨癒合效果,對於即將公布的台美二期臨床試驗結果抱持高度期待。此發展不僅將博晟定位為骨再生技術的領導者,也為未來的國際合作和授權機會打開了大門。日本和台美進行的臨床試驗將提供堅實的數據基礎,支持進一步的臨床發展和市場擴展的可能性。
自成立以來,博晟在高階骨科再生技術及感染症藥物開發和銷售領域取得顯著進展,公開上市後,公司不斷加強在產品研發、生產製造、銷售推廣等方面的實力,持續強化其在醫療技術領域的競爭力。
公司的主要收入來自於對抗多重抗藥性細菌的抗生素、軟骨再生產品以及醫療器材代工服務。特別是在骨骼和關節再生的高風險醫療器材開發方面,博晟正處於開發高效骨缺損修復解決方案的前沿,為臨床治療提供了新的選擇。
隨著博晟準備公布其脛骨骨折二期臨床試驗的結果,醫療科技行業密切關注,期待骨癒合治療領域的下一步發展。
博晟骨生長因子台美臨床試驗完成收案,為骨不癒合患者帶來曙光
避免法律糾紛,轉載本區文稿請先徵得原作者同意!
文章回應
目前尚無回應,成為第一個回應的人吧!
回應本篇文章!
(以下回應不會連結到FaceBook)(言責自負,請勿涉及人身攻擊,以免挨告!)
尚未 登入會員 ,無法回應!